





《第十七章 碱金属和碱土金属碱金属部分PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为976 KB,总共有28页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 28页
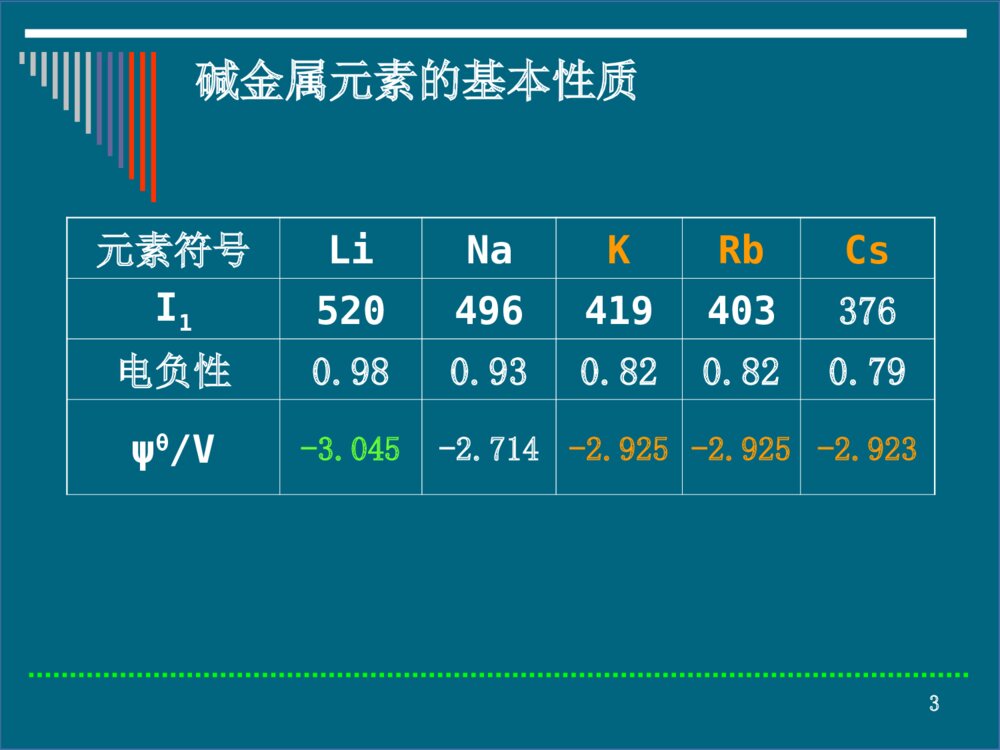
- 976 KB
- VIP模板
- ppt
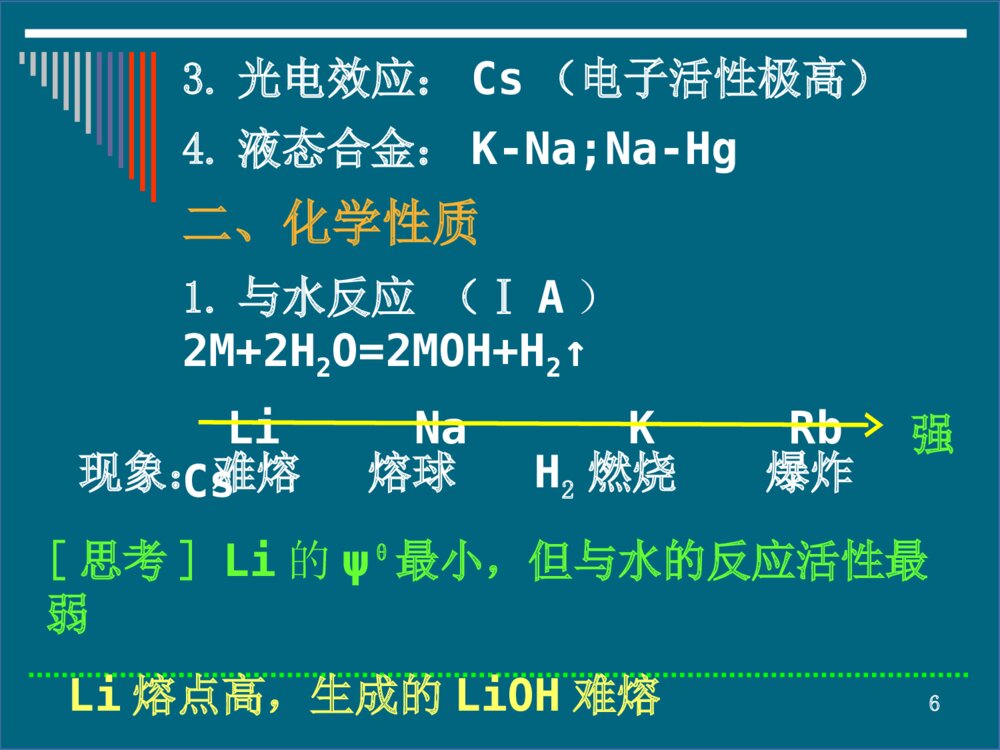
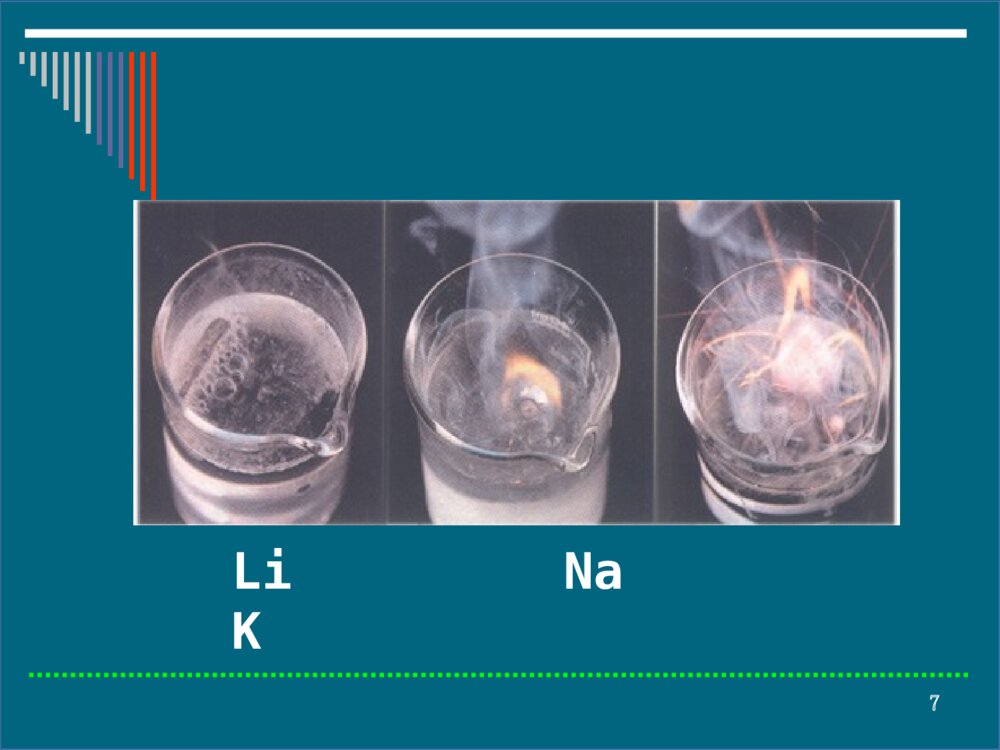
- 数字产品不支持退货
1第十七章碱金属和碱土金属碱金属部分一、碱金属的通性二、碱金属的单质三、化合物四、离子晶体盐类的溶解性2§17-1碱金属的通性ⅠA:Li、Na、K、Rb、Cs、(Fr)⑴金属活动性逐渐增强⑵化合物以离子型为主,Li的部分化合物有明显的共价性。3碱金属元素的基本性质元素符号LiNaKRbCsI1520496419403376电负性0.980.930.820.820.79ψθ/V-3.045-2.714-2.925-2.925-2.9234LiNaKRbCs原子半径增大金属性、还原性增强电离能、电负性减小5§17-2碱金属的单质一、物理性质通性银白色光泽,熔沸点低,硬度小,密度小,导电性好,延展性好。1.储存:Li(ρ=0.534g·cm-3),最轻的金属,浸在液体石蜡或封存在固体石蜡中,其它金属一般放在煤油中。2.切割:皆可用刀切割。最软Cs(硬度0.2).63.光电效应:Cs(电子活性极高)4.液态合金:K-Na;Na-Hg二、化学性质1.与水反应(ⅠA)2M+2H2O=2MOH+H2↑LiNaKRbCs强现象:难熔熔球H2燃烧爆炸[思考]Li的ψθ最小,但与水的反应活性最弱Li熔点高,生成的LiOH难熔7LiNaK8ⅡAM+2H2O=M(OH)2+H2↑BeMgCaSrBa强与水蒸气反应与热水反应冷水中反应Ca与水的反应92.与其它非金属反应,空气中易氧化3.颜色反应碱金属的挥发性化合物,在无色火焰中灼烧时,能使火焰呈现出一定颜色。Li:红色Na:黄色10K、Rb、Cs:紫色(通过钴玻璃观察)11利用焰色反应只可鉴定单个离子4.与液氨作用碱金属等与液氨作用生成蓝色溶液,放置时能缓慢释放H2.2Na(s)+2NH3(l)=2Na++2NH2-+H2(g)12三、制备1.熔盐电解法熔盐:氯化物(熔点低)+助熔剂助熔剂CaCI2的作用⑴降低电解质的熔点,防止钠挥发.(熔点:NaCI,1073K;Na:熔点371K;沸点1156K;混合盐,873K.)2NaCI2Na+CI2电解CaCI213⑵减小Na的分散性。(混合物密度大,液Na可浮其上)此法不适合制K(Rb、Cs)A:K易溶于熔融KCI中B:电解过程中产生的KO2和K会发生爆炸反应2.热还原法(用碳或碳化物做还原剂)2KF+CaC2CaF2+2C+2K1273-1423K143.金属置换法[主制K、Rb、Cs(高温、低压)]KCI+Na=NaCI+K↑2RbCI+Ca=CaCI2+2Rb↑2CsAIO2+Mg=MgAI2O4+2Cs↑[思考]不活泼金属置换活泼金属,是否与金属活泼性顺序矛盾?15§17-3化合物一、氧化物普通氧化物过氧化物超氧化物臭氧化物ⅠANa2ONa2O2NaO2KO3普通氧化物(O2-)过氧化物(O22-)超氧化物(O2-)622p2s2s14242222222)()()()()(p*pps*sπσσσKK3242222222)()()()()(p*pps*sπσσσKK161.碱金属氧化物**碱金属在空气中充分燃烧的产物碱金属在空气中充分燃烧的产物碱金属LiNaKRbCsO2Li2ONa2O2MO2N2Li3N--------17⑴普通氧化物制备4Li+O2=2Li2ONa2O2+2Na=2Na2O2KNO3+10K=6K2O+N2性质:Li2ONa2OK2ORb2OCs2O颜色白白淡黄亮黄橙红稳定性较稳定熔点前即分解减弱与水反应LiOH↓MOH18⑵过氧化物Na2O2:2Na+O2=Na2O2(淡黄粉末)Na2O2+2H2O=2NaOH+H2O2(→H2O+O2)Na2O2+H2SO4=Na2SO4+H2O2(→H2O+O2)2Na2O2+2CO2=2Na2CO3+O2↑Cr2O3+3Na2O2=2Na2CrO4+Na2O2NaCrO2+3Na2O2+2H2O=2Na2CrO4+4NaOHMnO2+Na2O2=Na2MnO4(熔矿剂)碱性条件下为强氧化剂,遇棉花、木炭等爆炸.19⑶超氧化物K(Rb、Cs)+O2→MO2(红色)2KO2+2H2O=2KOH+H2O2+O2↑2KO2+H2SO4=K2SO4+H2O2+O2↑4KO2+2CO2=2K2CO3+3O2↑过氧化物、超氧化物广泛用做引火剂、供氧剂、漂白剂。⑷臭氧化物(KO3、RbO3、CsO3)3KOH(s)+2O3(g)=2KO3(s)+KOH·H2O(s)+1/2O2(g)RO3不稳定→RO2+O24MO3+2H2O=4MOH+5O2↑20二、氢氧化物1.碱金属氢氧化物物理性质:⑴白色固体,除LiOH外,均易溶于水并放出大量热。⑵固体在空气中易吸湿潮解,NaOH可用做干燥剂。⑶对纤维、皮肤及其它有机物具有强腐蚀性-苛性碱(熔融或蒸浓NaOH时,可用Ag、Ni或Fe制容器)。LiOHNaOHKOHRbOHCsOH碱性中强强强强强水溶性难易易易易21化学性质:⑴与酸、酸性氧化物及盐等反应2NaOH+CO2=Na2CO3+H2O配不含Na2CO3溶液:先配饱和液,静置,Na2CO3↓,清液用煮沸冷却的蒸馏水冲稀。NaOH+NH4CI=NaCI+H2O+NH3↑实验室制NH3↑6NaOH+Fe2(SO4)3=2Fe(OH)3↓+3Na2SO4除去溶液中的杂质Fe3+22⑵与两性金属(Zn、AI)、某些非金属(B、Si)及其氧化物反应2AI+2NaOH+6H2O=2Na[AI(OH)4]+3H2↑AI2O3+2NaOH=2NaAIO2+H2OSi+2NaOH(浓)+H2O=Na2SiO3+2H2↑SiO2+2NaOH=Na2SiO3+H2O(玻璃瓶用橡皮塞)23⑶与多变价非金属(CI2、Br2、I2、P、S)发生歧化反应X2+6OH-=5X-+XO3-+3H2O3S+6NaOH=2Na2S+Na2SO3+3H2OP4+3KOH+3H2O=3KH2PO2+PH324判断主族金属氢氧化物的经验公式RO+H+←ROH→R++OH-酸性两性碱性2.32.32.22.2m)10100.1:r(rZ离子半径,单位R的φ值越大,静电引力越强,R吸引氧原子电子云的能力越强,ROH的酸性越强。25三、盐类1.晶体类型LiCI共价型,余离子型.2.颜色M+、M2+无论晶体还是水溶液均无色.若与之结合的阴离子(不包括X-)无色,则盐无色或白色;若阴离子有色,则化合物一般显阴离子的颜色,如K2Cr2O7(橙红色),KMnO4(紫红)。263.溶解性碱金属盐大多易溶,部分锂盐及少数大阴离子组成的盐微溶或难溶Li:LiF、Li2CO3、Li3PO4、LiKFeIO6(高碘酸铁钾锂]等难溶Na:Na[Sb(OH)6]、NaZn(UO2)3(Ac)9·6H2O[六羟基合锑(Ⅴ)酸钠][醋酸铀铣锌钠]K,Rb,Cs:M3[Co(NO2)6]、MB(C6H5)4、MCIO4、M2[PtCI6]等难溶274.稳定性碱金属盐1.卤化物:高温挥发不分解2.硫酸盐:不挥发,难分解3.碳酸盐:Li2CO3在1543K分解,余难分解4.硝酸盐:4LiNO3=2Li2O+4NO2↑+O2↑2MNO3=2NaNO2+O2↑(M=Na,K,Rb,Cs)285.形成结晶水合物的倾向碱金属LiNaKRbCs减小M+离子半径越小,作用于水分子的电场越强,水合热越大,水合物越稳定。6.水解性碱金属弱酸盐均水解-碱性



















